Trong chương trình hóa học 12, các bạn cần nắm được kiến thức về nhận biết một số chất khí bằng phương pháp hóa học. Trong nội dung bài viết chi tiết dưới đây, DINHNGHIA.COM.VN sẽ giúp bạn tìm hiểu cụ thể về chuyên đề nhận biết một số chất khí cùng các dạng bài tập liên quan.
Nội dung bài viết
Nhận biết chất khí bằng phương pháp hóa học là gì?
Nguyên tắc khi giải bài tập nhận biết chất khí
- Để nhận biết cũng như phân biệt các hóa chất, ta cần dựa vào phản ứng đặc trưng cũng như có hiện tượng dễ dàng nhận biết được: như có chất kết tủa tạo thành sau phản ứng, đổi màu dung dịch hoặc giải phóng chất có mùi, hay có hiện tượng sủi bọt khí. Bên cạnh đó, ta cũng có thể sử dụng một số tính chất vật lí như độ tan, dễ bị phân hủy hoặc có mùi đặc trưng,…
- Để nhận biết một số chất khí thì phản ứng hoá học được chọn phải đặc trưng đơn giản và có dấu hiệu rõ rệt. Trừ trường hợp đặc biệt, thông thường muốn nhận biết n hoá chất cần phải tiến hành (n – 1) thí nghiệm.
- Thuốc thử chính là các chất được lựa chọn để nhận biết một số chất khí.

Các bước tiến hành nhận biết chất khí
- Bước 1: Chiết (trích mẫu thử) các hóa chất cần nhận biết vào các ống nghiệm và (đánh số thứ tự)
- Bước 2: Chọn thuốc thử thích hợp (tuỳ theo yêu cầu đề bài: thuốc thử tuỳ chọn, hạn chế hay không dùng thuốc thử nào khác).
- Bước 3: Cho vào các ống nghiệm ghi nhận các hiện tượng xảy ra và rút ra kết luận.
- Bước 4: Viết phương trình hóa học minh hoạ.
Các dạng bài tập nhận biết một số chất khí
- Dạng 1: Nhận biết các hoá chất (rắn, lỏng hay khí) một cách riêng biệt.
- Dạng 2: Nhận biết các chất được đựng trong các lọ mất nhãn riêng biệt.
- Dạng 3: Cần xác định sự có mặt của các chất (hoặc các ion) trong cùng một dung dịch.
- Lưu ý: Tuỳ theo yêu cầu của bài tập mà trong mỗi dạng có thể gặp 1 trong các trường hợp sau:
- Nhận biết với các thuốc thử tự do (tuy nhiên không hạn chế thuốc thử).
- Với những thuốc thử hạn chế (dùng 1 thuốc thử và không được dùng thêm các hóa chất khác).
- Nhận biết không được dùng thuốc thử bên ngoài (Với yêu cầu như này thì ta tạo cần kẻ bảng sẽ giúp vừa nhận biết hóa chất đồng thời cũng vừa lấy chất đó làm thuốc thử).
Tìm hiểu và nhận biết hóa chất đối với chất khí
Khí CO
- Thuốc thử: Dung dịch PdCl2
- Hiện tượng: dung dịch bị sẫm màu, có khí thoát ra
- Phương trình phản ứng:
CO+H2O+PdCl2→2HCl+CO2+Pd
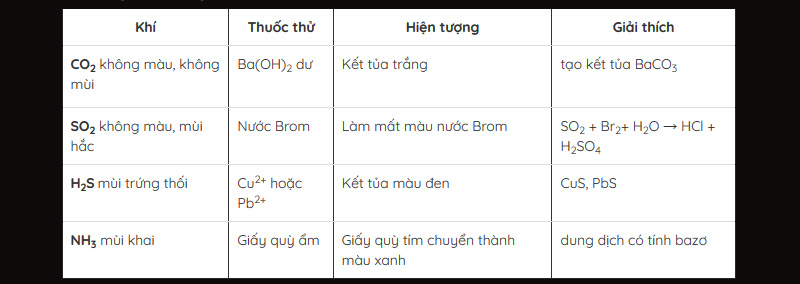
Khí CO2
- Thuốc thử: Sử dụng dịch nước vôi trong
- Hiện tượng xảy ra là làm đục nước vôi trong sau đó dung dịch trở nên trong suốt.
- Phương trình phản ứng:
CO2+Ca(OH)2→CaCO3+H2O
CaCO3+H2O+CO2→Ca(HCO3)2
Khí SO2
- Khí SO2 thường có mùi hắc khó ngửi, khó ngưởi và làm phai màu hoa hồng.
- Thuốc thử: Sử dụng dung dịch brom hoặc dung dịch thuốc tím.
- Hiện tượng: Làm mất màu dung dịch nước Brom hoặc làm mất màu dung dịch thuốc tím.
- Phương trình phản ứng:
Br2+2H2O+SO2→H2SO4+2HBr
5SO2+2KMnO4+2H2O→2H2SO4+2MnSO4+K2SO4
Khí SO3
- Thuốc thử: Dung dịch BaCl2
- Hiện tượng: Xuất hiện kết tủa trắng.
- Phương trình phản ứng:
BaCl2+H2O+SO3→2HCl+BaSO4
Khí NH3
- Khí NH3 có mùi khai, làm cho quỳ tím tẩm ướt hoá xanh.
- Thuốc thử: Axit HCl đặc
- Hiện tượng: Xuất hiện khói trắng
- Phương trình phản ứng:
HCl+NH3→NH4Cl
Khí clo
- Thuốc thử: Dùng dung dịch KI + Hồ tinh bột
- Hiện tượng: Dung dịch từ màu trắng chuyển thành màu xanh.
- Phương trình phản ứng:
Cl2+KI→2KCl+I2
Khí H2S
- Khí H2S có mùi trứng thối.
- Thuốc thử: Dùng dung dịch Pb(NO3)2
- Hiện tượng: Sản phẩm tạo thành là PbS kết tủa màu đen.
- Phương trình phản ứng:
Pb(NO3)2+H2S→PbS+2HNO3
Khí HCl
- Khí HCl làm giấy quỳ tẩm ướt hoá đỏ.
- Thuốc thử: Dung dịch AgNO3
- Hiện tượng: Sản phẩm tạo thành kết tủa màu trắng của AgCl.
- Phương trình phản ứng:
AgNO3+HCl→AgCl+HNO3
Khí NO (không màu)
- Thuốc thử: Không khí
- Hiện tượng: hoá màu nâu đỏ
- Phương trình phản ứng:
2NO+O2→2NO2
Khí NO2
- Thuốc thử: Quỳ tím ẩm
- Hiện tượng: Làm quỳ tím hóa đỏ
- Hoặc làm lạnh màu nâu đỏ nhạt dần sau đó mất màu, khi hết làm lạnh lại xuất hiện màu nâu đỏ.
- Phương trình phản ứng:
2NO2→N2O4
Khí O3 (ozon)
- Thuốc thử: Dung dịch KI và hồ tinh bột
- Hiện tượng: tạo thành dung dịch màu tím xanh
- Phương trình phản ứng:
O3+2KI+H2O→KOH+I2+O2
Khí O2
- Thuốc thử: Than đỏ
- Hiện tượng: Than bùng cháy.
- Phương trình phản ứng:
C+O2→CO2
Khí N2
- Thuốc thử: Que diêm đỏ
- Hiện tượng: Khí N2 làm que diêm tắt.
Một số bài tập về nhận biết chất khí
Dạng 1: Bài tập không hạn chế thuốc thử hoặc phương pháp sử dụng
Ví dụ 1: Có 2 bình riêng biệt đựng các khí CO2 và SO2. Hãy trình bày cách nhận biết từng khí. Viết các phương trình hóa học.
Cách giải:
Dẫn hai khí lần lượt lội qua dung dịch nước brom nếu khí nào làm mất màu dung dịch nước brom là SO2.
Khí còn lại dẫn vào bình đựng nước vôi trong nếu thấy kết tủa làm nước vôi trong vẩn đục là CO2
Phương trình phản ứng:
SO2+Br2+2H2O→2HBr+H2SO4
CO2+Ca(OH)2→CaCO3+H2O
Dạng 2: Bài tập hạn chế thuốc thử hoặc phương pháp sử dụng
Đây là dạng bài tập yêu cầu học sinh phải giải quyết vấn đề của bài tập theo một điều kiện nhất định .
Ví dụ 2: Có các lọ hóa chất không nhãn, mỗi lọ đựng một trong các dung dịch không màu sau:
Na2SO4,Na2S,Na2CO3,Na3PO4,Na2SO3. Chỉ dùng thuốc thử là dung dịch H2SO4 loãng nhỏ trực tiếp vào từng dung dịch thì có thể nhận biết được những dung dịch nào ?
Cách giải:
Cho dung dịch H2SO4 loãng lần lượt vào 5 lọ đựng 5 dung dịch:
- Lọ nào có khí không màu không mùi là Na2CO3
Na2CO3+H2SO4→Na2SO4+H2O+CO2
- Lọ nào có khí mùi trứng thối là Na2S
Na2S+H2SO4→Na2SO4+H2S
- Lọ nào có khí không màu mùi xốc là Na2SO3
Na2SO3+H2SO4→Na2SO4+H2O+SO2
- 2 lọ còn lại không hiện tượng
⇒ Nhận biết được 3 dung dịch là Na2CO3,Na2S,Na2SO3
Xem thêm:
- Phương trình hóa học là gì? Ý nghĩa và Các dạng bài tập
- Công thức hóa học là gì? Ý nghĩa và Bài tập về công thức hóa học
- Điều chế khí oxi là gì? Phản ứng phân hủy là gì? – Hóa học 8 Bài 27
Như vậy DINHNGHIA.ComVN đã cùng bạn tìm hiểu về kiến thức nhận biết một số chất khí. Hy vọng những thông tin trong bài viết sẽ giúp ích cho bạn trong quá trình nghiên cứu cũng như tìm hiểu chuyên đề nhận biết một số chất khí. Chúc bạn luôn học tập tốt!.


